Przykładowe typy inhibicji produktami reakcji
Poniżej przedstawiono wpływ stężenia substratu i inhibitora na szybkość reakcji
enzymatycznej [mg*min/ml]. Przy obliczeniach przyjęto wartości wyznaczone dla procesów enzymatycznej degradacji skrobi. Przyjęto także, że stężenie enzymu we wszystkich przykładach jest jednakowe i wynosi 0.05 mg/ml.
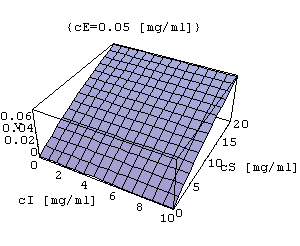
Brak inhibicji
- szybkość reakcji nie zależy od stężenia inhibitora.
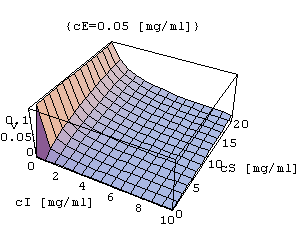
Inhibicja konkurencyjna
- inhibitor konkuruje z substratem przy zajmowaniu miejsca aktywnego w cząsteczce enzymu.
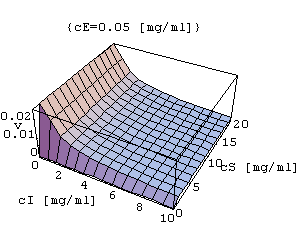
Inhibicja niekompetycyjna
- inhibitor przyłącza się do enzymu w innym miejscu niż substrat.
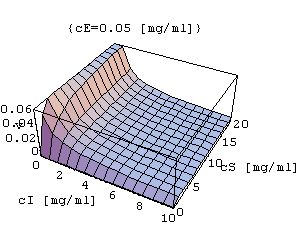
Inhibicja akompetycyjna
- inhibitor wiąże się jedynie z kompleksem enzym-substrat.Powyższe wykresy trójwymiarowe uzyskano wykorzystując program
Mathematica firmy Wolfram Research, Inc., poprzez wydanie następujących komend:
kM=48.0081953280565;
k3=5.140009;
cE=0.05;
MM=Plot3D[k3*cE*cS/(kM+cS),{cI,0,10},{cS,0,20},AxesLabel->{"cI[mg/ml]","cS[mg/ml]","v"},PlotLabel->{"cE=0.05[mg/ml]"}]
k3=2.84309239965976;
kM=0.000258532498056238;
ki=0.000018503160141176;
cE=0.05;
IK=Plot3D[k3*cE*cS/(kM+cS+kM*cI/ki),{cI,0,10},{cS,0,20},AxesLabel->{"cI[mg/ml]","cS[mg/ml]","v"},PlotLabel->{"cE=0.05[mg/ml]"}]
kM=0.000259151241017125;
k3=0.898048575919244;
ki=0.474563898861419;
cE=0.05;
INK=Plot3D[k3*cE*cS/(kM+cS+kM*cI/ki+cI*cS/ki),{cI,0,10},{cS,0,20},AxesLabel->{"cI[mg/ml]","cS[mg/ml]","v"},PlotLabel->{"cE=0.05[mg/ml]"}]
kM=2617.3623337874;
k3=1790.57869072011;
ki=0.000564545672270411;
cE=0.05;
IUK=Plot3D[k3*cE*cS/(kM+cS+cI*cS/ki),{cI,0,10},{cS,0,20},AxesLabel->{"cI[mg/ml]","cS[mg/ml]","v"},PlotLabel->{"cE=0.05[mg/ml]"}]
© Piotr Wojciechowski, Wrocław 1998